澳门十大赌博正规官网
《分析化学实验》指导书
熊建龙 编著
2010年03月
第一章 分析化学实验基本知识
第一节 分析化学实验的要求
分析化学是一门实践性很强的学科。分析化学实验与分析化学理论教学紧密结合,是化工、环境、生物、医药等专业的基础课程之一。
学生通过本课程的学习,可以加深对分析化学基本概念和基本理论的理解;正确和较熟练地掌握分析化学实验基本操作,学习分析化学实验的基本知识,掌握典型的化学分析方法;树立“量”的概念,运用误差理论和分析化学理论知识,找出实验中影响分析结果的关键环节,在实验中做到心中有数、统筹安排,学会正确合理地选择实验条件和实验仪器,正确处理实验数据,以保证实验结果准确可靠;培养良好的实验习惯,实事求是的科学态度、严谨细致的工作作风和坚韧不拔的科学品质;提高观察、分析和解决问题的能力,为学习后续课程和将来参加工作打下良好的基础。
为了达到上述目的,对分析化学实验课提出以下基本要求:
1.认真预习 每次实验前必须明确实验目的和要求,了解实验步骤和注意事项,写好预习报告,做到心中有数。
2.仔细实验,如实记录,积极思考 实验过程中,要认真地学习有关分析方法的基本操作技术,在教师的指导下正确使用仪器,要严格按照规范进行操作。细心观察实验现象,及时将实验条件和现象以及分析测试的原始数据记录在实验记录本上,不得随意涂改;同时要勤于思考分析问题,培养良好的实验习惯和科学作风。
3.认真写好实验报告 根据实验记录进行认真整理、分析、归纳、计算,并及时写好实验报告。实验报告一般包括实验名称、实验日期、实验原理、主要试剂和仪器及其工作条件、实验步骤、实验数据及其分析处理、实验结果和讨论。实验报告应简明扼要,图表清晰。
4.严格遵守实验室规则,注意安全 保持实验室内安静、整洁。实验台面保持清洁,仪器和试剂按照规定摆放整齐有序。爱护实验仪器设备,实验中如发现仪器工作不正常,应及时报告教师处理。实验中要注意节约。安全使用电、水和有毒或腐蚀性的试剂。每次实验结束后,应将所用的试剂及仪器复原,清洗好用过的器皿,整理好实验室。
第二节 分析化学实验的一般知识
一、玻璃器皿的洗涤
分析化学实验中使用的玻璃器皿应洁净透明,其内外壁能为水均匀地润湿且不挂水珠。
(一)洗涤方法
洗涤分析化学实验用的玻璃器皿时,一般要先洗去污物,用自来水冲净洗涤液,至内壁不挂水珠后,再用纯水(蒸馏水或去离子水)淋洗三次。去除油污的方法视器皿而异,烧杯、锥形瓶、量筒和离心管等可用毛刷蘸合成洗涤剂刷洗。滴定管、移液管、吸量管和容量瓶等具有精密刻度的玻璃量器,不宜用刷子刷洗,可以用合成洗涤剂浸泡一段时间。若仍不能洗净,可用铬酸洗液洗涤。洗涤时先尽量将水沥干,再倒入适量铬酸洗液洗涤,注意用完的洗液要倒回原瓶,切勿倒入水池。光学玻璃制成的比色皿可用热的合成洗涤剂或盐酸-乙醇混合液浸泡内外壁数分钟(时间不宜过长)。
(二)常用的洗涤剂
1.铬酸洗液 是饱和K2Cr2O7的浓溶液,具有强氧化性,能除去无机物、油污和部分有机物。其配制方法是:称取10gK2Cr2O7(工业级即可)于烧杯中,加入约20mL热水溶解后,在不断搅拌下,缓慢加入200mL浓H2SO4冷却后,转入玻璃瓶中,备用。铬酸洗液可反复使用,其溶液呈暗红色,当溶液呈绿色时,表示已经失效,须重新配制。铬酸洗液腐蚀性很强,且对人体有害,使用时应特别注意安全,也不可将其倒入水池。
2.合成洗涤剂 主要是洗衣粉、洗洁精等,适用于去除油污和某些有机物。
3.盐酸-乙醇溶液 是化学纯盐酸和乙醇(1:2)的混合溶液,用于洗涤被有色物污染的比色皿、容量瓶和移液管等。
4.有机溶剂洗涤液 主要是丙酮、乙醚、苯或NaOH的饱和乙醇溶液,用于洗去聚合物、油脂及其他有机物。
二、实验室安全知识
分析化学实验中,经常使用水、电、大量易破损的玻璃仪器和一些具有腐蚀甚至易燃、易爆或有毒的化学试剂。为确保人身和实验室的安全而且不污染环境,实验中须严格遵守实验室的安全规则。主要包括:
(一)禁止将食物和饮料带进实验室,实验中注意不用手摸脸、眼等部位。一切化学药品严禁入口,实验完毕后必须洗手。
(二)使用浓酸、浓碱以及其他腐蚀性试剂时,切勿溅在皮肤和衣物上。涉及浓硝酸、盐酸、硫酸、高氯酸、氨水等的操作,均应在通风橱内进行。夏天开启浓氨水、盐酸时一定先用自来水将其冲冷却,再打开瓶盖。使用汞、汞盐、砷化物、氰化物等剧毒品时,要实行登记制度,取用时要特别小心,切勿泼洒在实验台面和地面上,用过的废物、废液切不可乱扔,应分别回收,集中处理。实验中的其他废物、废液也要按照环保的要求妥善处理。
(三)注意防火。实验室严禁吸烟。万一发生火灾,要保持镇静,立即切断电源或燃气源,并采取针对性的灭火措施。一般的小火用湿布、防火布或沙子覆盖燃烧物灭火。不溶于水的有机溶剂以及能与水起反应的物质如金属钠,一旦着火,绝不能用水浇,应用沙土压或用二氧化碳灭火器灭火。如电器起火,不可用水冲,应当用四氯化碳灭火器灭火。情况紧急应立即报警。
(四)使用各种仪器时,要在教师讲解或自己仔细阅读并理解操作规程后,方可动手操作。
(五)安全使用水、电。离开实验室时,应仔细检查水、电、气、门窗是否关好。
(六)如发生烫伤和割伤应及时处理,严重者应立即送医院治疗。
第二章 化学分析实验的基本操作技术
第一节 分析天平
分析天平是定量分析工作中最重要、最常用的精密称量仪器。每一项定量分析都直接或间接地需要使用天平,而分析天平称量的准确度对分析结果又有很大的影响,因此,我们必须了解分析天平的构造并掌握正确的使用方法,避免因天平的使用或保管不当影响称量的准确度,从而获得准确的称量结果。常用的分析天平有等臂双盘天平(包括半自动电光天平和全自动电光天平)和单盘天平。这些天平在构造上虽然有些不同,但其构造的基本原理都是根据杠杆原理设计制造的。
一、称量原理
天平是根据杠杆原理制成的,它用已知质量的砝码来衡量被称物体的质量。

设杠杆ABC的支点为B(如上图),AB和BC的长度相等,A、C两点是力点,A点悬挂的被称物体的质量为P,C点悬挂的砝码质量为Q。当杠杆处于平衡状态时,力矩相等,即: P×AB=Q×BC
因为AB=BC,所以P=Q,即天平称量的结果是物体的质量。
目前国内使用最为广泛的是半自动电光天平,本节对其作简单介绍。
二、半自动电光天平
(一)双盘半机械加码电光天平的构造
电光天平是根据杠杆原理设计的,尽管其种类繁多,但其结构却大体相同,都有底板、立柱、横梁、玛瑙刀、刀承、悬挂系统和读数系统等必备部件,还有制动器、阻尼器、机械加码装置等附属部件。不同的天平其附属部件不一定配全。
双盘半机械加码电光天平的构造如图2-1所示。
(二)使用方法
1.调节零点
电光天平的零点是指天平空载时,微分标尺上的“0”刻度与投影屏上的标线相重合的平衡位置。接通电源,开启天平,若“0”刻度与标线不重合,当偏离较小时,可拨动调屏拉杆,移动投影屏的位置,使其相合,即调定零点;若偏离较大时,则需关闭天平,调节横梁上的平衡螺丝(这一操作由老师进行),再开启天平,继续拨动调屏拉杆,直到调定零点,然后关闭天平,准备称量。
2.称量
将称量物放入左盘并关好左门,估计其大致质量,在右盘上放入稍大于称量物质质量的砝码。选择砝码应遵循“由大到小,折半加入,逐级试验”的原则。试加砝码时,应半开天平,观察指针的偏移和投影屏上标尺的移动情况。根据“指针总是偏向轻盘,投影标尺总是向重盘移动”的原则,以判断所加砝码是否合适以及如何调整。克组码调定后,关上右门,再依次调定百毫克组及十毫克组圈码,每次从折半量开始调节。十毫克圈码组调定后,完全开启天平,平衡后,从投影屏上读出10mg以下的读数。克组砝码数、指数盘刻度数及投影屏上读数三者之和即为称量物的质量,及时将称量数据记录在实验记录本上。
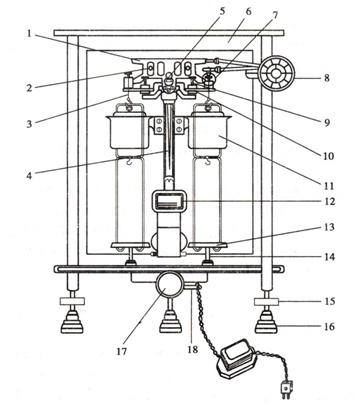
图2-1双盘半机械加码电光天平
1.横梁 2.平衡螺丝 3.吊耳 4.指针 5.支点刀 6.框罩 7.圈码
8.指数盘 9.承重刀 10.折叶 11.阻尼筒 12.投影屏 13.秤盘
14.盘托 15.螺旋脚 16.垫脚 17.升降旋钮 18.调屏拉杆
三、分析天平的使用规则
(一)称量前先将天平罩取下叠好,放在天平箱上面,检查天平是否处于水平状态,用软毛刷清刷天平,检查和调整天平的零点。
(二)旋转升降旋钮时必须缓慢,轻开轻关。取放称量物、加减砝码和圈码时,都必须关闭天平,以免损坏玛瑙刀口。
(三)天平的前门不得随意打开,它主要供安装、调试和维修天平时使用。称量时应关好侧门。化学试剂和试样都不得直接放在秤盘上,应放在干净的表面皿、称量瓶或坩埚内;具有腐蚀性的气体或吸湿性物质,必须放在称量瓶或其他适当的密闭容器中称量。
(四)取放砝码必须用镊子夹取、严禁手拿。加减砝码和圈码均应遵循“由大到小,折半加入,逐级试验”的原则。旋转指数盘时,应一档一档地慢慢转动,防止圈码跳落互撞。试加减砝码和圈码时应慢慢半开天平试验。
(五)天平的载重不能超过天平的最大负载。在同一次实验中,应尽量使用同一台天平和同一组砝码,以减少称量误差。
(六)称量的物体必须与天平箱内的温度一致,不得把热的或冷的物体放进天平称量。为了防潮,在天平箱内应放置有吸湿作用的干燥剂。
(七)称量完毕,关闭天平,取出称量物和砝码,将指数盘拨回零位。检查砝码是否全部放回盒内原来的位置和天平内外的清洁,关好侧门。然后检查零点,将使用情况登记在天平使用登记薄上,再切断电源,最后罩上天平罩,将座凳放回原处。
第二节 滴定分析的仪器和基本操作
 在滴定分析中,滴定管、容量瓶、移液管和吸量管是准确测量溶液体积的量器。通常体积测量相对误差比称量要大,而分析结果的准确度是误差最大的那项因素所决定。因此,必须准确测量溶液的体积以得到正确的分析结果。溶液体积测量的准确度不仅取决于所用量器是否准确,更重要的是取决于准备和使用量器是否正确。现将滴定分析常用器皿及其基本操作分述如下:
在滴定分析中,滴定管、容量瓶、移液管和吸量管是准确测量溶液体积的量器。通常体积测量相对误差比称量要大,而分析结果的准确度是误差最大的那项因素所决定。因此,必须准确测量溶液的体积以得到正确的分析结果。溶液体积测量的准确度不仅取决于所用量器是否准确,更重要的是取决于准备和使用量器是否正确。现将滴定分析常用器皿及其基本操作分述如下:
一、滴定管
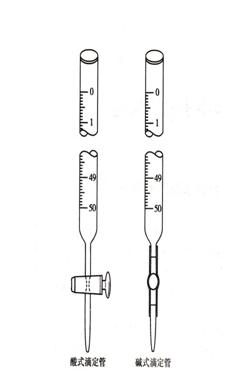
滴定管是滴定时用来准确测量流出标准溶液体积的量器。它的主要部分管身是用细长而且内径均匀的玻璃管制成,上面刻有均匀的分度线,下端的流液口为一尖嘴,中间通过玻璃旋塞或乳胶管连接以控制滴定速度。常量分析用的滴定管标称容量为50mL和25mL,最小刻度为0.1mL,读数可估计到0.01mL。
滴定管一般分为两种:一种是酸式滴定管,另一种是碱式滴定管(图2-2)。酸式滴定管的下端有玻璃活塞,可盛放酸液及氧化剂,不宜盛放碱液。碱式滴定管的下端连接一橡皮管,内放一玻璃珠,以控制溶液的流出,下面再连一尖嘴玻管,这种滴定管可盛放碱液,而不能盛放酸或氧化剂等腐蚀橡皮的溶液。
滴定管的使用:
(一)洗涤:使用滴定管前先用自来水洗,再用少量蒸馏水淋洗2-3次,每次5-6mL,洗净后,管壁上不应附着有液滴;最后用少量滴定用的待 图2-2滴定管
装溶液洗涤二次,以免加入滴定管的待装溶液被蒸馏水稀释。
(二)装液:将待装溶液加入滴定管中到刻度“0”以上,开启旋塞或挤压玻璃球,把滴定管下端的气泡逐出,然后把管内液面的位置调节到刻度“0”。排气的方法如下:如果是酸式滴定管,可使溶液急速下流驱去气泡。如为碱式滴定管,则可将橡皮管向上弯曲,并在稍高于玻璃珠所在处用两手指挤压,使溶液从尖嘴口喷出,气泡即可除尽(如图2-3)。
(三)读数:常用滴定管的容量为50mL,每一大格为1mL,每一小格为0.1mL,读数可读到小数点后两位。读数时,滴定管应保持垂直。视线应与管内液体凹面的最低处保持水平,偏低偏高都会带来误差。(见图2-4)
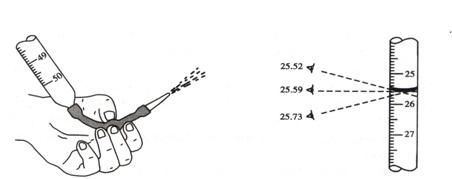
图2-3 碱式滴定管排气 图2-4 目光在不同位置得到的滴定管读数
 (四)滴定:滴定开始前,先把悬挂在滴定管尖端的液滴除去,滴定时用左手控制阀门,右手持锥形瓶,并不断旋摇,使溶液均匀混和。将到滴定终点时,滴定速度要慢,最后一滴一滴地滴入,防止过量,并且用洗瓶挤少量水淋洗瓶壁,以免有残留的液滴未起反应。最后,必须待滴定管内液面完全稳定后,方可读数。 图2-5 滴定操作
(四)滴定:滴定开始前,先把悬挂在滴定管尖端的液滴除去,滴定时用左手控制阀门,右手持锥形瓶,并不断旋摇,使溶液均匀混和。将到滴定终点时,滴定速度要慢,最后一滴一滴地滴入,防止过量,并且用洗瓶挤少量水淋洗瓶壁,以免有残留的液滴未起反应。最后,必须待滴定管内液面完全稳定后,方可读数。 图2-5 滴定操作
二、容量瓶
容量瓶主要是用来精确地配制一定体积和一定浓度的溶液的量器,如用固体物质配制溶液,应先将固体物质在烧杯中溶解后,再将溶液转移至容量瓶中。转移时,要使玻璃棒的下端靠近瓶颈内壁,使溶液沿玻棒缓缓流入瓶中,再从洗瓶中挤出少量水淋洗烧杯及玻

图2-6 转移溶液入容量瓶 图2-7 混均操作
璃棒2-3次,并将其转移到容量瓶中(见图2-6)。接近标线时,要用滴管慢慢滴加,直至溶液的弯月面与标线相切为止。塞紧瓶塞,用左手食指按住塞子,将容量瓶倒转几次直到溶液混匀为止(见图2-7)。容量瓶的瓶塞是磨口的,一般是配套使用。
容量瓶不能久贮溶液,尤其是碱性溶液,它会侵蚀瓶塞使其无法打开。也不能用火直接加热及烘烤。使用完毕后应立即洗净。如长时间不用,磨口处应洗净檫干,并用纸片将磨口隔开。
三、移液管
移液管用于准确移取一定体积的溶液。通常有两种形状,一种移液管中间有膨大部分,称为胖肚移液管;另一种是直形的,管上有分刻度,称为吸量管。
移液管在使用前应洗净,并用蒸馏水润洗3遍。使用时,洗净的移液管要用被吸取的溶液润洗3遍,以除去管内残留的水分。吸取溶液时,一般用左手拿洗耳球,右手把移液管插入溶液中吸取。当溶液吸至标线以上时,马上用右手食指按住管口,取出,微微移动食指或用大拇指和中指轻轻转动移液管,使管内液体的弯月面慢慢下降到标线处,立即压紧管口;把移液管移入另一容器(如锥形瓶)中,并使管尖与容器壁接触,放开食指让液体自由流出;流完后再等15s左右。残留于管尖内的液体不必吹出,因为在校正移液管时,未把这部分液体体积计算在内。
使用刻度吸管时,应将溶液吸至最上刻度处,然后将溶液放出至适当刻度,两刻度之差即为放出溶液的体积。
第三节 重量分析基本操作
重量分析包括挥发法、萃取法、沉淀法,其中以沉淀法的应用最为广泛,在此仅介绍沉淀法的基本操作。沉淀法的基本操作包括:沉淀的进行,沉淀的过滤和洗涤,烘干或灼烧,称重等。为使沉淀完全、纯净,应根据沉淀的类型选择适宜的操作条件,对于每步操作都要细心地进行,以得到准确的分析结果。下面主要介绍沉淀的过滤、洗涤和转移的基础知识和基本操作。
一、沉淀的过滤
根据沉淀在灼烧中是否会被纸灰还原及称量形式的性质,选择滤纸或玻璃滤器过滤。
(一)滤纸的选择 定量滤纸又称无灰滤纸(每张灰分在0.1mg以下或准确已知)。由沉淀量和沉淀的性质决定选用大小和致密程度不同的快速、中速和慢速滤纸。晶形沉淀多用致密滤纸过滤,蓬松的无定形沉淀要用较大的疏松的滤纸。由滤纸的大小选择合适的漏斗,放入的滤纸应比漏斗沿低约0.5~1cm。
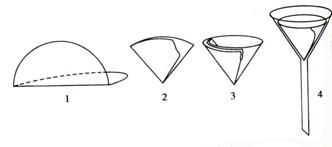
图2-8 滤纸的折叠和安放
(二)滤纸的折叠和安放 如图2-8所示:先将滤纸沿直径对折成半圆(1),再根据漏斗的角度的大小折叠(可以大于90°,见2)。折好的滤纸,一个半边为三层,另一个半边为单层,为使滤纸三层部分紧贴漏斗内壁,可将滤纸的上角撕下(3),并留做檫拭沉淀用。将折叠好的滤纸放在洁净的漏斗中,用手指按住滤纸,加蒸馏水至满,必要时用手指小心轻压滤纸,把留在滤纸与漏斗壁之间的气泡赶走,使滤纸紧贴漏斗并使水充满漏斗颈形成水柱,以加快过滤速度。
 (三)沉淀的过滤 一般多采用“倾泻法”过滤。操作如图2-9所示:将漏斗置于漏斗之上,接受滤液的洁净烧杯放在漏斗下面,使漏斗颈下端在烧杯边沿以下3~4cm处,并与烧杯内壁靠紧。先将沉淀倾斜静置,然后将上层清液小心倾入漏斗滤纸中,使清液先通过滤纸,而沉淀尽可能地留在烧杯中,尽量不搅动沉淀,操作时一手拿住玻璃棒,使与滤纸近于垂直,玻璃棒位于三层滤纸上方,但不和滤纸接触。另一只手拿住盛沉淀的烧杯,烧杯嘴靠住玻璃棒,慢慢将烧杯倾斜,使上层清液沿着玻璃棒流入滤纸中,随着滤液的流注,漏斗中液体的体积增加,至滤纸高度的2/3处,停止倾注(切勿注满),停止倾注时,可沿玻璃棒将烧杯嘴往上提一小段,扶正烧杯;在扶正烧杯以前不可将烧杯嘴离开玻璃棒,并注意不让沾在玻璃棒上的液滴或沉淀损失,把玻璃棒放会烧杯内,但勿把玻璃棒靠在烧杯嘴部。 图2-9 倾泻法过滤操作和倾斜静置
(三)沉淀的过滤 一般多采用“倾泻法”过滤。操作如图2-9所示:将漏斗置于漏斗之上,接受滤液的洁净烧杯放在漏斗下面,使漏斗颈下端在烧杯边沿以下3~4cm处,并与烧杯内壁靠紧。先将沉淀倾斜静置,然后将上层清液小心倾入漏斗滤纸中,使清液先通过滤纸,而沉淀尽可能地留在烧杯中,尽量不搅动沉淀,操作时一手拿住玻璃棒,使与滤纸近于垂直,玻璃棒位于三层滤纸上方,但不和滤纸接触。另一只手拿住盛沉淀的烧杯,烧杯嘴靠住玻璃棒,慢慢将烧杯倾斜,使上层清液沿着玻璃棒流入滤纸中,随着滤液的流注,漏斗中液体的体积增加,至滤纸高度的2/3处,停止倾注(切勿注满),停止倾注时,可沿玻璃棒将烧杯嘴往上提一小段,扶正烧杯;在扶正烧杯以前不可将烧杯嘴离开玻璃棒,并注意不让沾在玻璃棒上的液滴或沉淀损失,把玻璃棒放会烧杯内,但勿把玻璃棒靠在烧杯嘴部。 图2-9 倾泻法过滤操作和倾斜静置
二、沉淀的洗涤和转移
(一)洗涤沉淀 一般也采用倾泻法,为提高洗涤效率,按“少量多次”的原则进行。即加入少量洗涤液,充分搅拌后静置,待沉淀下沉后,倾泻上层清液,再重复操作数次后,将沉淀转移到滤纸上。
(二)转移沉淀 在烧杯中加入少量洗涤液,将沉淀充分搅起,立即将悬浊液一次转移到滤纸中。然后用洗瓶吹洗烧杯内壁、玻璃棒,再重复以上操作数次;这时在烧杯内壁和玻璃棒上可能仍残留少量沉淀,这时可用撕下的滤纸角檫拭,放入漏斗中。然后如图2-10进行最后冲洗。
沉淀全部转移完全后,再在滤纸上进行洗涤,以除尽全部杂质。注意在用洗瓶冲洗时是自上而下螺旋式冲洗(如图2-11),以使沉淀集中在滤纸锥体最下部,重复多次,直至检查无杂质为止。

图2-10 沉淀转移操作 图2-11在滤纸上洗涤沉淀
第三章 定量分析实验
实验一 酸碱标准溶液的配制及标定
一、实验目的:
1.学习酸碱标准溶液的配制、标定和浓度的比较。
2.学习滴定操作,初步掌握准确地确定终点的方法。
3.学习滴定分析中容量器皿等的正确使用。
4.熟悉指示剂色性质和终点颜色的变化。
5.学习使用分析天平及减量法。
二、实验原理:
NaOH滴定HAc,是一个强碱滴定弱酸的实验,滴定的突跃范围处于碱性,因此选用酚酞作指示剂,终点时变色敏锐。

由于氢氧化钠易吸收空气中的水份和二氧化碳,因此不能直接法配制标准溶液,必需用基准物质进行标定。一般常用邻苯二甲酸氢钾(KHC8H4O4)作为基准物质。此试剂易制得纯品,摩尔质量大(204.2g/mol),在空气中不易吸潮,容易保存,是标定碱的较好的基准物质。它与NaOH的定量反应如下:

滴定产物是KNaC8H4O4,溶液呈弱碱性。故与上面相同,也选用酚酞作指示剂。
标定NaOH溶液浓度亦可用草酸(H2C2O4∙2H2O)作基准物质,与NaOH的定量反应如下:

三、主要试剂和仪器
1.NaOH 固体
2.HAc 0.1mol∙L-1
3.酚酞 0.1%乙醇溶液
4.邻苯二甲酸氢钾(KHC8H4O4) 固体,在100~125℃干燥后备用
四、实验步骤
1.0.1mol∙L-1NaOH溶液的配制:
在台秤上用表面皿称取固体NaOH1.8g~2.0g于烧杯中,加水50mL,搅拌使之溶解,再加水400mL,搅拌均匀备用。
2.用NaOH溶液滴定HAc:
从酸式滴定管中以每分钟10mL的速度放出0.1mol∙L-1的HAc溶液10.00~15.00mL于锥形瓶中,加1~2滴0.1%酚酞指示剂,用0.1mol∙L-1的NaOH溶液滴定。滴定时不停的摇动锥形瓶,直到加入1滴或半滴NaOH溶液后,溶液由无色变为微红色;然后加1~2滴0.1mol∙L-1的NaOH溶液,溶液呈红色;再由酸式滴定管中加入HAc溶液,使溶液变无色;再用用0.1mol∙L-1的NaOH溶液滴定至微红色。如此反复练习滴定操作和观察滴定终点,读准最后所用HAc和NaOH溶液的体积数;并求出滴定时两溶液的体积比VNaOH:VHAc,平行滴定三份,直至三次测定结果的平均偏差在0.1%之内。
3.NaOH溶液的标定
准确称取邻苯二甲酸氢钾0.4~0.5g两份,分别置于250mL锥形瓶中,加水30mL使之溶解,加入1~2滴0.1%酚酞指示剂,用NaOH溶液滴定至溶液呈微红色,在半分钟内不褪色即为终点,记下每份滴定时所消耗的NaOH溶液体积,根据消耗的NaOH体积和邻苯二甲酸氢钾用量即可计算NaOH溶液的准确浓度。
再根据VNaOH:VHAc,计算出HAc的准确浓度。
五、思考题
1.为什么NaOH标准溶液配制后需用基准物质进行标定?
2.滴定分析中,滴定管与移液管使用前需用所装的溶液进行润洗,那么所用的烧杯或锥形瓶是否也要用所装的溶液进行润洗?为什么?
3.进行滴定时,滴定管读数为什么应从“0.00”开始?
4.用邻苯二甲酸氢钾标定NaOH时,为什么选用酚酞作指示剂?用甲基橙或甲基红作指示剂是偏高?
实验二 工业纯碱总碱度的测定
一、实验目的
1. 了解基准物质碳酸钠及硼砂的分子式和化学性质。
2. 掌握HCl标准溶液的配制、标定过程。
3. 掌握强酸滴定二元弱碱的滴定过程,突跃范围及指示剂的选择。
4. 掌握定量转移操作的基本要点。
二、实验原理
工业纯碱的主要成分为碳酸钠,商品名为苏打,其中可能还含有少量NaCl,Na2SO4,NaOH及NaHCO3等成分。常以HCl标准溶液为滴定剂测定总碱度来衡量产品的质量。滴定反应:
Na2CO3+2HCl=2NaCl+H2CO3
H2CO3=CO2↑+H2O
反应产物H2CO3易形成过饱和溶液并分解为CO2逸出。化学计量点时溶液pH为3.8至3.9,可选用甲基橙为指示剂,用HCl标准溶液滴定,溶液由黄色转变为橙色即为终点。试样中NaHCO3同时被中和。
由于试样易吸收水分和CO2,应在270~300℃将试样烘干2h,以除去吸附水并使NaHCO3全部转化为Na2CO3,工业纯碱的总碱度通常以w(Na2CO3)或w(Na2O)表示,由于试样均匀性较差,应称取较多试样,使其更具代表性。测定的允许误差可适当放宽一点。
三、主要试剂和仪器
1.HCl溶液 0.1mol L-1 配制时应在通风橱中操作。用量杯量取原装浓盐酸约9mL,倒入试剂瓶中,加水稀释至1L,充分摇匀。
2.无水Na2CO3 于180℃干燥2~3h。也可将NaHCO3置于瓷坩锅内,在270~300℃的烘箱内干燥1h,使之转变为Na2CO3。然后放入干燥器内冷却后备用。
3.甲基橙指示剂 1g·L-1。
4.甲基红 2 g·L-1 60%的乙醇溶液。
5.甲基红-溴甲酚绿混合指示剂 将2 g·L-1甲基红的乙醇溶液与1g·L-1溴甲酚绿乙醇溶液以1+3体积相混合。
6.硼砂(Na2B4O7·10H2O) 应在置有NaCl和蔗糖的饱和溶液的干燥器内保存,以使相对湿度为60%,防止结晶水失去。
四、实验步骤
1.0.1mol·L-1HCl溶液的标定
(1)用无水Na2CO3基准物质标定 用称量瓶准确称取0.15g-0.20g无水Na2CO33份,分别倒入250mL锥形瓶中。称量瓶称样时一定要带盖,以免吸湿。然后加入20-30mL水使之溶解,再加入1-2滴甲基橙指示剂,用待标定的HCl溶液滴定至溶液的黄色恰变为橙色即为终点。计算HCl溶液的浓度。
(2)用硼砂Na2B4O7·10H2O标定 准确称取硼砂0.4~0.6g3份,分别倾入250mL锥形瓶中,加水50mL使之溶解,加入2滴甲基红指示剂,用待标定的HCl溶液滴定至溶液由黄色恰变为浅红色即为终点。根据硼砂的质量和滴定时所消耗的HCl溶液的体积,计算HCl溶液的浓度。
2.总碱度的测定
准确称取试样约2g倾入烧杯中,加少量水使其溶解,必要时可稍加热促进溶解。冷却后,将溶液定量转入250mL容量瓶中,加水稀释至刻度,充分摇匀。平行移取试液25.00mL三份于锥形瓶中,加入1~2滴甲基橙指示剂,用HCl标准溶液滴定溶液由黄色恰变为橙色即为终点。计算试样中Na2O或Na2CO3含量,即为总碱度。测定的各次相对偏差应在±0.5%以内。
五、思考题
1. 为什么配制0.1mol·L-1HCl溶液1L需要量取浓HCl溶液9mL?写出计算式。
2. 无水Na2CO3保存不当,吸收了1%的水分,用此基准物质标定HCl溶液浓度时,对其结果产生何种影响?
3. 甲基橙,甲基红及甲基红-溴甲酚绿混合指示剂的变色范围各为多少?混合指示剂优点是什么?
4. 标定HCl的两种基准物质Na2CO3和Na2B4O7·10H2O各有那些有缺点?
5. 在以HCl溶液滴定时,怎样使用甲基橙及酚酞两种指示剂来判别试样是由NaOH-Na2CO3或Na2CO3-NaHCO3组成的?
实验三 铋、铅含量的连续滴定
一、实验目的
1. 了解由调节酸度提高EDTA选择性的原理。
2. 掌握用EDTA进行连续滴定的方法。
二、实验原理
混合离子的滴定常用控制酸度法、掩蔽法进行,可根据有关副反应系数原理进行计算,论证对它们分别滴定的可能性。
Bi3+,Pb2+均能与EDTA形成稳定的1:1络合物,lgK分别为27.94和18.04。由于两者的lgK相差很大,故可利用酸效应,控制不同的酸度,进行分别滴定。在pH≈1时滴定Bi3+,在pH≈5~6时滴定Pb2+。
在Bi3+~Pb2+混合溶液中,首先调节溶液的pH≈1,以二甲酚橙为指示剂,Bi3+与指示剂形成紫红色络合物(Pb2+在此条件下不会与二甲酚橙形成有色络合物),用EDTA标液滴定Bi3+,当溶液由紫红色恰变为黄色,即为滴定Bi3+的终点。

在滴定Bi3+后的溶液中,加入六亚甲基四胺溶液,调节溶液pH=5~6,此时Pb2+与二甲酚橙形成紫红色络合物,溶液再次呈现紫红色,然后用EDTA标液继续滴定,当溶液由紫红色恰转变为黄色时,即为滴定Pb2+的终点。

三、主要试剂和仪器
1. EDTA溶液。
2. 二甲酚橙 2 g·L-1。
3. 六亚甲基四胺溶液 200 g·L-1。
4. HCl溶液 (1+1)。
5. Bi3+,Pb2+混合液 含Bi3+,Pb2+各约0.01 mol·L-1。称取48 gBi(NO3)3,33 gPb(NO3)2,移入含312 mL HNO3的烧杯中,在电炉上微热溶解后,稀释至10L。
四、操作步骤
Bi3+-Pb2+混合液的测定 用移液管移取25.00 mLBi3+-Pb2+溶液3份于250mL锥形瓶中,加入1-2滴二甲酚橙指示剂,用EDTA标液滴定,当溶液由紫红色恰变为黄色,即为Bi3+的终点。根据消耗的EDTA体积,计算混合液中Bi3+的含量(以g·L-1表示)。
在滴定Bi3+后的溶液中,滴加六亚甲基四胺溶液,至呈现稳定的紫红色后,再过量加入5mL,此时溶液的pH约5-6。用EDTA标准溶液滴定,当溶液由紫红色恰变为黄色,即为终点。根据滴定结果,计算混合液中Pb2+的含量(以g·L-1表示)。
五、思考题
1. 描述连续滴定Bi3+,Pb2+过程中,锥形瓶中颜色变化的情形,以及颜色变化的原因。
2. 为什么不用NaOH,NaAc或NH3·H2O,而要用六亚甲基四胺调节pH到5~6?
3. 本实验中,能否先在pH=5~6的溶液中,测定Bi3+和Pb2+的合量,然后再调整pH≈1时测定Bi3+含量。
实验四 水的硬度测定
一、实验目的
1. 掌握EDTA法测定水硬度的原理和方法。
2. 了解测定水的硬度的意义和我国常用的硬度表示方法。
3. 了解金属指示剂的特点,并掌握铬黑T和钙指示剂的性质、应用及终点时颜色的变化。
二、实验原理
含有钙镁盐类的水叫硬水(硬度小于5.6度的一般可称软水)。硬度有暂时硬度和永久硬度之分。凡水中含有钙、镁的酸式钙酸盐,遇热即成钙酸盐沉淀而失去其硬度则为暂时硬度;凡水中含有钙、镁的硫酸盐、氯化物、硝酸盐等所成的硬度称为永久硬度。
暂时硬度和永久硬度的总和称为“总硬”。由Mg2+离子形成的硬度称为“镁硬”,由Ca2+离子形成的硬度称为“钙硬”。
水的硬度表示方法有多种,目前我国采用二种表示方法:一种是以CaO的m·mol∙L-1计,表示1L水中所含CaO的m·mol数,其硬度表示为

另一种表示方法是以度°计,1硬度单位表示十万份水中含一份CaO,1°=10ppmCaO,其硬度表示为:

式中 CEDTA—EDTA标准溶液的浓度 mol∙L-1;
VEDTA—滴定时用去的EDTA标准溶液的体积,若为滴定总硬时所用去的,则所得硬度为总硬;若为滴定钙硬时用去的体积,则所得硬度为钙硬;
V水样—水样的体积(mL)。
水中钙镁离子含量,可用EDTA法测定总硬度,测定时控制溶液的酸度为pH≈10,铬黑T为指示剂,以EDTA标准溶液滴定水中Ca2+、Mg2+,由EDTA浓度和用量,可计算出水的总硬度。钙硬是在溶液pH≥12时,以钙指示剂作为指示剂,用EDTA标准溶液滴定水中Ca2+,由EDTA浓度和用量,可算出水钙硬,由总硬度减去钙硬即为镁硬。
三、主要试剂及仪器
1.NaOH 20%;
2.HCl 1:1;
3.三乙醇胺 1:2;
4.氨性缓冲溶液 pH≈10,溶解67gNH4Cl于少量水中,加入570mL浓氨水,用水稀释至1升;
6.钙指示剂 称0.5g钙指示剂与100gNaCl研细混匀置于小广口瓶中,保存于干燥器中备用;
7.铬黑T指示剂 0.5%,称0.5g铬黑T,加入20mL三乙醇胺,用水稀释至100mL;
8.EDTA标准溶液0.02mol∙L-1。
四、实验步骤
总硬的测定:量取澄清的水样100mL于锥形瓶中,加入1~2滴1:1HCl使之酸化,并主沸数分钟除去CO2,冷却后加入1:2三乙醇胺5mL,pH≈10氨性缓冲溶液5mL,1~3滴铬黑T,摇匀,用EDTA标准溶液滴定,溶液由紫红色转变为纯蓝色即为终点,记下消耗EDTA体积V1。
钙硬的测定:量取澄清的水样100mL于锥形瓶中,加入20%NaOH5mL,摇匀,再加入少许钙指示剂,摇匀,此时溶液呈淡红色,用EDTA标准溶液滴定至溶液呈纯蓝色即为终点。记下消耗EDTA体积V2。
镁硬的确定:由总硬度减钙硬即镁硬。
附注
(1)若水样不清,则必须过滤,过滤所用的器皿和滤纸必须是干燥的,最初的滤液须弃去。
(2)若水中含有铜、锌、锰、铁、铝等离子,则会影响测定结果,可加入1%Na2S溶液1mL使Cu2+、Zn2+等成硫化物沉淀,过滤。猛的干扰可加入盐酸羟胺消除。
(3)在氨性液中,Ca(HCO3)2含量较高时,可能慢慢析出CaCO3沉淀,使滴定终点拖长,变色不敏锐,所以滴定前最好将溶液酸化,煮沸除去CO2,注意HCl不可多加,否则影响滴定时溶液的pH值。
五、思考题:
1. 什么叫水的硬度?水的硬度单位有几种表示方法?
2. 用EDTA法怎么测出总硬?用什么作指示剂?试液的pH值应控制在什么范围?实验中是如何控制的?
3. 用EDTA法测定水的硬度时,哪些离子存在有干扰?应如何消除?
实验五 石灰石或白云石中钙镁的测定
一、实验目的
1. 学习络合滴定法测定石灰石或白云石中钙镁的含量,并进一步掌握络合滴定原理。
2. 学习络合滴定法中采用掩蔽剂消除共存离子的干扰及反应条件。
二、实验原理
石灰石、白云石的主要成分是CaCO3和MgCO3以及少量Fe、Al、Si等杂质,故通常不需分离即可直接滴定。试样用HCl分解后,钙镁等以Ca2+、Mg2+离子进入溶液,调节试液pH为10,用铬黑T(或K-B)作指示剂,以EDTA标准溶液滴定试液中Ca、Mg合量。于另一份试液中,调节pH≥12,Mg2+生成Mg(OH)2沉淀,用钙指示剂作指示剂,用EDTA标准溶液单独滴定Ca2+。
由于试样中含有少量铁铝等干扰杂质,所以滴定前在酸性条件下,加入三乙醇胺掩蔽Fe3+、Al3+,如试样中含有铜、钛、镉、铋等微量黑金属,可加入铜试剂(DDTC)消除干扰。
如试样成分复杂,样品溶解后,可在试液中加入六次甲基四胺和铜试剂,使Fe3+、Al3+和重金属离子同时沉淀除去,过滤后即可按上述方法分别测定钙镁。
三、主要试剂及仪器
1.NaOH 20%;
2.HCl 1:1;
3.三乙醇胺 1:2;
4.盐酸羟胺 固体;
5.氨性缓冲溶液 pH≈10,溶解67gNH4Cl于少量水中,加入570mL浓氨水,用水稀释至1升;
6.钙指示剂 称0.5g钙指示剂与100gNaCl研细混匀置于小广口瓶中,保存于干燥器中备用;
7.铬黑T指示剂 0.5%,称0.5g铬黑T,加入20mL三乙醇胺,用水稀释至100mL;
8.EDTA标准溶液 0.02mol∙L-1。
四、实验步骤
准确称取0.3g试样于烧杯中,加水数滴润湿,盖以表面皿,从烧杯嘴慢慢加入1:1HCl10~20mL,加热使之溶解,将试样全溶后,冷却、定量转移入250mL容量瓶中,用水稀至刻度,摇匀。
钙、镁总量测定:用移液管吸取25.00mL试样溶液于250mL锥形瓶中,加水20mL,少许盐酸羟胺,1:2三乙醇胺5mL,摇匀,加入pH≈10氨性缓冲溶液10mL,1~3滴铬黑T,用EDTA标准溶液滴定,溶液由紫红色转变为纯蓝色即为终点,记下消耗EDTA体积V1。
钙含量的测定:另外吸取试液25.00mL于250mL锥形瓶中,加水20mL,少许盐酸羟胺,1:2三乙醇胺5mL,20%NaOH10mL,少许钙指示剂,摇匀,用EDTA标准溶液滴定,溶液由红色变为纯蓝色即为终点,记下消耗EDTA体积V2。
根据EDTA的浓度及二次消耗量,可算出试样中CaO、MgO百分含量。
附注:
1. 用三乙醇胺掩蔽Fe3+、Al3+,必须在酸性溶液中加入,然后再行碱化。
2. 测定钙时,如试样中有大量镁存在,由于Mg(OH)2沉淀吸附Ca2+,使钙的结果偏低,为此可加入淀粉-甘油、阿拉伯树胶或糊精等保护胶,基本上可消除吸附现象,其中以糊精效果较好。5%糊精溶液的配制如下:称取5g糊精于100mL沸水中,冷却,加入20%NaOH 5mL,搅匀,加入3~5滴K-B指示剂,用EDTA溶液滴至溶液呈蓝色,临时配用,使用时加10~15mL于试液中。
五、思考题
1. 用酸分解石灰石或白云石试样时应注意什么?实验中怎样判断试样已分解完全。
2. 用EDTA法测定钙镁,加入氨性缓冲溶液和氢氧化钠各起什么作用?
3. 用EDTA法测定钙镁时,试样中有少量铁铝铜锌等干扰?若有干扰应如何消除。
4. 用三乙醇胺掩蔽Fe3+、Al3+时,为什么要在酸性液中加入三乙醇胺后才提高溶液的pH值?
实验六 溴酸钾法测定苯酚
一、实验目的
1. 了解和掌握以溴酸钾法与碘量法配合使用来间接测定苯酚的原理和方法。
2. 掌握碘量瓶的使用方法。
3. 了解“空白试验”的意义和作用,学会“空白试验”的方法和应用。
二、实验原理
苯酚是煤焦油的主要成分之一,也是许多高分子材料、合成染料、医药和农药等方面的主要原料,还被广泛用于消毒、杀菌。由于苯酚的生产和广泛应用,造成环境污染,因此对它是常规检测的主要项目之一
对苯酚的测定是基于苯酚与Br2作用生成稳定的三溴苯酚(白色沉淀):

由于上述反应进行较慢,而且Br2极易挥发,因此不能用Br2液直接滴定,而应用过量Br2与苯酚进行溴代反应。由于Br2液浓度不稳定,一般使用KBrO3(含有KBr)标准溶液在酸性介质中反应以产生游离Br2:

溴代反应完毕后,过量的Br2再用还原剂标准溶液滴定。但是一般常用的还原性滴定剂Na2S2O3易为Br2、Cl2等较强氧化剂非定量地氧化为SO42-离子,因而不能用Na2S2O3直接滴定Br2(而且Br2易挥发损失)。因此过量的Br2应与过量KI作用,置换出I2:

析出的I2再用Na2S2O3标准溶液滴定:

在这个测定中,Na2S2O3溶液的浓度是在与测定苯酚相同条件下进行标定得到的。这样可以减少由于Br2的挥发损失等因素而引起的误差。
同时,加入的Br2量也不是由KBrO3-KBr标准溶液的用量计算获得,而是由空白实验实际测得,这样可以减少由于Br2的挥发损失等因素而引起的误差。
由上述反应可以看出,被测苯酚与滴定剂Na2S2O3间存在如下的化学计量关系:


从而可容易地确定苯酚与Na2S2O3的化学计量关系。再由加入的Br2量(即空白试验消耗的Na2S2O3的量)和剩余的Br2量(滴定试样消耗Na2S2O3的量)计算试样中苯酚的含量。
三、主要试剂和仪器
1.KBrO3-KBr标准溶液  。
。
2. Na2S2O3标准溶液 0.05mol∙L-1。
3.淀粉溶液 1%。
4.KI溶液 10%。
5.HCl 1+1。
四、实验步骤
准确吸取试液10.00mL于250mL碘量瓶中,再吸取10.00mL KBrO3-KBr标准溶液加入碘量瓶中,并加入10mLHCl(1+1)溶液,迅速加塞振荡1~2分钟,此时生成白色三溴苯酚沉淀和Br2,再避光静置5~10分钟,水封。加入10%KI溶液①10mL,摇匀,避光静置5~10分钟,水封。用少量水冲洗瓶塞及瓶颈上附著物,再加水10mL;最后用Na2S2O3标准溶液滴定至淡黄色,加10滴1%淀粉溶液,继续滴定至蓝色消失,即为终点②。记下消耗的Na2S2O3标准溶液体积V。并同时做空白实验③,消耗的Na2S2O3标准溶液体积V空。根据实验结果计算苯酚含量。(mg/L)
附注:
①加KI溶液时,不要打开瓶塞,只能稍松开瓶塞,使KI溶液沿瓶塞流入,以免Br2挥发损失。
②三溴苯酚沉淀易包裹I2故在近终点时,应剧烈振荡碘量。
③空白实验:即准确吸取10.00mL KBrO3-KBr标准溶液加入250mL碘量瓶中,并加入15mL去离子水及6~10mLHCl(1+1)溶液,迅速加塞振荡1~2分钟,再避光静置5分钟,以下操作与测定苯酚相同。
五、思考题
1. 什么叫“空白试验”?它的作用是什么?由空白试验的结果怎样计算KBrO3-KBr标准溶液的浓度(即加入的Br2总量)?这与通常使用基准物质标定标准溶液有何异同?有何优点?
2. 为什么测定苯酚要在碘量瓶中进行?若用锥形瓶代替碘量瓶会产生什么影响?
3. 试分析溴酸钾法测定苯酚的主要误差来源。
实验七 铁矿中全铁含量的测定
一、实验目的
1.掌握K2Cr2O7标准溶液的配制及使用。
2.学习矿石试样的酸溶法。
3.学习K2Cr2O7法测定铁的原理及方法。
4.对无汞定铁有所了解,增强环保意识。
5.了解二苯胺磺酸钠指示剂的作用原理。
二、实验原理
用HCl溶液分解铁矿石后,在热HCl溶液中,以甲基橙为指示剂,用SnCl2将Fe3+还原至Fe2+,并过量1~2滴。经典方法是用HgCl2氧化过量的SnCl2,除去Sn2+的干扰,但HgCl2造成环境污染,本实验采用无汞定铁法。还原反应为
2FeCl4-+SnCl42-+2Cl-=2FeCl42-+SnCl62-
使用甲基橙指示SnCl2还原Fe3+的原理是:Sn2+将Fe3+还原完后,过量的Sn2+可将甲基橙还原为氢化甲基橙而褪色,不仅指示了还原的终点,Sn2+还能继续使氢化甲基橙还原成N,N-二甲基对苯二胺和对氨基苯磺酸,过量的Sn2+则可以消除。反应为

以上反应为不可逆的,因而甲基橙的还原产物不消耗K2Cr2O7。
HCl溶液浓度应控制在4 mol·L-1,若大于6 mol·L-1,Sn2+会先将甲基橙还原为无色,无法指示Fe3+的还原反应。HCl溶液浓度低于2 mol·L-1,则甲基橙褪色缓慢。
滴定反应为:

滴定突跃范围为0.93~1.34V,使用二苯胺磺酸钠为指示剂时,由于它的条件电位为0.85V,因而需加入H3PO4使滴定生成的Fe3+生成Fe(HPO4)2-而降低Fe3+/Fe2+电对的电位,使突跃范围变成0.71~1.34V,指示剂可以在此范围内变色,同时也消除了FeCl4-黄色对终点观察的干扰,Sb(Ⅴ),Sb(Ⅲ)干扰本实验,不应存在。
三、主要试剂和仪器
1.SnCl2 100g·L-1 10 gSnCl2·2H2O溶于40mL浓热HCl溶液中,加水稀释至100mL。
2.SnCl2 50g·L-1。
3.H2SO4-H3PO4混酸将15mL浓H2SO4缓慢加至70mL水中,冷却后加入15mL浓H3PO4混匀。
4.甲基橙 1 g·L-1。
5.二苯胺磺酸钠2 g·L-1。
6.K2Cr2O7标准溶液 =0.05000 mol·L-1 将K2Cr2O7在150~180℃干燥2h,至于干燥器中冷却至室温。用指定质量称量法准确称取0.6127gK2Cr2O7于小烧杯中,加水溶解,定量转移至250 mL容量瓶中,加水稀释至刻度,摇匀。
=0.05000 mol·L-1 将K2Cr2O7在150~180℃干燥2h,至于干燥器中冷却至室温。用指定质量称量法准确称取0.6127gK2Cr2O7于小烧杯中,加水溶解,定量转移至250 mL容量瓶中,加水稀释至刻度,摇匀。
四、实验步骤
准确称取铁矿石粉1.0~1.5g于250mL烧杯中,用少量水润湿,加入20mL浓HCl溶液,盖上表面皿,在通风柜中低温加热分解试样,若有带色不溶残渣,可滴加20~30滴100 g·L-1SnCl2助溶。试样分解完全时,残渣应接近白色(SiO2),用少量水吹洗表面皿及烧杯壁,冷却后转移至250mL容量瓶中,稀释至刻度并摇匀。
移取试样溶液25.00mL于锥形瓶中,加8mL浓HCl溶液,加热近沸,加入6滴甲基橙,趁热边摇动锥形瓶边逐滴加入100g·L-1 SnCl2还原Fe3+。溶液由橙变红,再慢慢滴加50 g·L-1 SnCl2至溶液变为淡粉色,再摇几下直至粉色褪去。立即用流水冷却,加50mL蒸馏水,20mL硫磷混酸,4滴二苯胺磺酸钠,立即用K2Cr2O7标准溶液滴定到稳定的紫红色为终点,平行测定3次,计算矿石中铁的含量(质量分数)。
五、思考题
1. K2Cr2O7为什么可以直接称量配制准确浓度的溶液?
2. 分解铁矿石时,为什么要在低温下进行?如果加热至沸会对结果产生什么影响?
3. SnCl2还原Fe3+的条件是什么?怎样控制SnCl2不过量?
4. 以K2Cr2O7溶液滴定Fe2+时,加入H3PO4的作用是什么?
实验八 可溶性硫酸盐中硫的测定
一、实验目的
1. 了解重量法测定硫的基本原理。
2. 学会重量分析的基本操作。
二、实验原理
将可溶性硫酸盐试样溶于水中,用稀盐酸酸化,加热近沸,不断搅拌下,缓慢滴加热BaCl2稀溶液,使生成难溶性硫酸钡沉淀。

硫酸钡是典型的晶形沉淀,因此应完全按照晶形沉淀的处理方法,所得沉淀经陈化后,过滤、洗涤、干燥和灼烧,最后以硫酸钡沉淀形式称量,求得试样中硫的含量。
1. 硫酸钡符合于定量分析的要求
(1)硫酸钡的溶解度小,在常温下为1×10-5mol∙L-1,在100℃时为1.3×10-5mol∙L-1,所以在常温和100℃时每100mL溶液中仅溶解0.23~0.3mg,不超出误差范围,可以忽略不计。
(2)硫酸钡沉淀的组成精确地与其化学式相符合,化学性质非常稳定,因此凡含硫的化合物将其氧化成硫酸根以及钡盐中的钡离子都可用硫酸钡的形式来测定。
2. 盐酸的作用
(1)利用盐酸提高硫酸钡沉淀的溶解度,以得到较大晶粒的沉淀,利于过滤沉淀。由实验得知,在常温下BaSO4的溶解度约为
盐酸浓度(mol∙L-1)
| 0.1
| 0.5
| 1.0
| 2.0
|
溶解度(mg∙L-1)
| 10
| 47
| 87
| 101
|
所以在沉淀硫酸钡时,不要使酸度过高,最适宜是在0.1mol∙L-1以下(约0.05mol∙L-1)的盐酸溶液中进行,即可将硫酸钡的溶解量忽略不计。
(2)在0.05mol∙L-1盐酸浓度下,溶液中若含有草酸根、磷酸根、碳酸根与钡离子不能发生沉淀,因此不会干扰。
(3)可防止盐类的水解作用,如有微量铁、铝等离子存在,在中性溶液中将因水解而生成碱式硫酸盐胶体微粒与硫酸钡一同沉出,实验证明,溶液的酸度增大,使三价离子共沉淀作用有显著的减小。
3. 硫酸钡沉淀的灼烧
硫酸钡沉淀不能立即高温灼烧,因为滤纸碳化后对硫酸钡沉淀有还原作用:

应先以小火使带有沉淀的滤纸慢慢灰化变黑,而绝不可着火,如不慎着火,应立即盖上坩埚盖使其熄灭,否则除发生反应外,尚能由于热空气流而吹走沉淀,必须特别注意。
如已发生还原作用,微量的硫化钡在充足空气中,可能氧化而重新成为硫酸钡:

若能灼烧达到恒重的沉淀,即上述氧化作用已告结束,沉淀已不含硫化钡。另外,灼烧沉淀的温度应不超过800℃,且不宜时间太长,以避免发生下列反应:

而引起误差,使结果偏低。
三、主要试剂及仪器
1.盐酸 2mol∙L-1。
2.氯化钡 10%。
3.硝酸银 0.1mol∙L-1。
四、实验步骤
准确称取在100~200℃干燥过的试样0.3g左右两份,分别置于400mL烧杯中,用水50mL溶解,加入2mol∙L-1盐酸6mL,加水稀释到约200mL,盖上表面皿加热近沸。
另取10%氯化钡溶液10mL两份,分别置于100mL烧杯中,加水40mL,加热至沸。在不断搅拌下,趁热用滴管吸取稀氯化钡溶液,逐滴加入试液中,沉淀作用完毕后,静置2min,待硫酸钡下沉,于上层清液中加1~2滴氯化钡溶液,仔细观察有无浑浊出现,以检验沉淀是否完全,盖上表面皿微沸10min,在室温下陈化12小时,以使试液上面悬浮微小晶粒完全沉下,溶液澄清。
过滤:取中速定量滤纸两张,按漏斗的大小折好滤纸使其与漏斗很好地贴合(见第二章第三节),以去离子水润湿,并使漏斗颈内留有水柱,将漏斗置于漏斗架上,漏斗下面各放一只清洁的烧杯,利用倾泻法小心地把上层清液沿玻璃棒慢慢倾入已准备好的漏斗中,尽可能不让沉淀倒入漏斗滤纸上,以免防碍过滤和洗涤。当烧杯中清液已经倾注完后,用热水洗沉淀4次(倾泻法),然后将沉淀定量转移到滤纸上,再用热水洗涤7~8次,用硝酸银检验不显浑浊(表示无氯离子)为止。沉淀洗净后,将盛有沉淀的滤纸折叠成小包,移入已在800℃灼烧至恒重的瓷坩埚中烘干,灰化后再置于800℃的马弗炉中灼烧1小时,取出,置于干燥器内冷却至室温、称量。根据所得硫酸钡量,计算试样中w(S)、w(SO42-)以及w(Na2SO4)。
五、思考题
1. 沉淀硫酸钡时为什么要在稀溶液,稀盐酸介质中进行沉淀?搅拌的目的是什么?
2. 为什么沉淀硫酸钡要在热溶液中进行而在冷却后进行过滤,沉淀后为什么要陈化?
3. 用倾泻法过滤有什么优点?
实验九 邻二氮菲吸光光度法测定铁
(条件试验和试样中铁含量的测定)
二、实验目的
1. 学习如何选择吸光光度分析的实验条件。
2. 掌握用吸光光度法测定铁的原理及方法。
3. 掌握分光光度计和吸量管的使用方法。
三、实验原理
铁的吸光光度法所用的显色剂较多,有邻二氮菲(又称邻菲啰啉,菲绕林)及其衍生物、磺基水杨酸、硫氰酸盐、5-Br-PADAP等。其中邻二氮菲分光光度法的灵敏度高,稳定性好,干扰容易消除,因而是目前普遍采用的一种方法。
在pH为2~9的溶液中,Fe2+与邻二氮菲(Phen)生成稳定的橘红色络合物
Fe(Phen)32+:
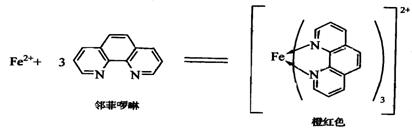
其中lgβ3=21.3,摩尔吸光系数ε508=1.1×104L·mol-1·cm-1。当铁为+3价时,可用盐酸羟胺还原:

Cu2+、Co2+、Ni2+、Cd2+、Hg2+、Mn2+、Zn2+等离子也能与Phen生成稳定络合物,在少量情况下,不影响Fe2+的测定,量大时可用EDTA隐蔽或预先分离。
吸光光度法的实验条件,如测量波长,溶液酸度、显色剂用量、显色时间、温度、溶剂以及共存离子干扰及其消除等,都是通过实验来确定的。本实验在测定试样中铁含量之前,先做部分条件试验,以便初学者掌握确定实验条件的方法。
条件试验的简单方法是:变动某实验条件,固定其余条件,测得一系列吸光度值,绘制吸光度-某实验条件的曲线,根据曲线确定某实验条件的适宜值或适宜范围。
四、主要试剂及仪器
1. 分光光度计,pH计,50mL容量瓶8个(或比色管8支)
2. 铁标准溶液 100 μg·mL-1准确称取0.8634 gAR NH4Fe(SO4)2·12H2O于200mL
烧杯中,加入20mL 6mol·L-1HCl溶液和少量水,溶解后转移至1L容量瓶中,稀释至刻度,摇匀。
3. 邻二氮菲 1.5 g·L-1。
4. 盐酸羟胺 100 g·L-1(用时配制)。
5. NaAc 1mol·L-1。
6. NaOH 1 mol·L-1。
7. HCl 6 mol·L-1。
五、实验步骤
1. 条件试验
(1)吸收曲线的制作和测量波长的选择 用吸量管吸取0.0mL和1.0mL铁标准溶液分别注入两个50mL容量瓶(或比色管)中,各加入1mL盐酸羟胺溶液,摇匀。再加入2mL Phen,5mL NaAc,用水稀释至刻度,摇匀。放置10min后,用1cm比色皿,以试剂空白(即0.0mL铁标准溶液)为参比溶液,在440~560nm之间,每隔10nm测一次吸光度,在最大吸收峰附近,每隔5nm测量一次吸光度。在坐标纸上,以波长λ为横坐标,吸光度A为纵坐标,绘制A与λ关系的吸收曲线。从吸收曲线上选择测定Fe的适宜波长,一般选用最大吸收波长λmax。
(2)溶液酸度的选择 取8个50mL容量瓶(或比色管),用吸量管分别加入1mL铁标准溶液,1mL盐酸羟胺,摇匀,再加入2mL Phen,摇匀。用5mL吸量管分别加入0.0mL,0.2 mL,0.5mL,1.0mL,1.5mL,2.0mL,2.5mL和3.0mL 1mol·L-1NaOH溶液,用水稀释至刻度,摇匀。放置10min。用1cm比色皿,以蒸馏水为参比溶液,在选择的波长下测定各溶液的吸光度。同时,用pH计测量各溶液的pH。以pH为横坐标,吸光度A为纵坐标,绘制A与pH关系的酸度影响曲线,得出测定铁的适宜酸度范围。
(3)显色剂用量的选择 取7个50mL容量瓶(或比色管),用吸量管各加入1mL铁标准溶液,1 mL盐酸羟胺,摇匀,再分别加入0.1mL,0.3mL,0.5mL,0.8mL,1.0mL,2.0mL,4.0mL Phen和5mL NaAc溶液,以水稀释至刻度,摇匀。放置10min。用1cm比色皿,以蒸馏水为参比溶液,在选择的波长下测定各溶液的吸光度。以所取Phen溶液体积V为横坐标,吸光度A为纵坐标,绘制A与V关系的显色剂用量影响曲线。得出测定铁时显色剂的最适宜用量。
(4)显色时间 在一个50mL容量瓶(或比色管)中,用吸量管加入1mL铁标准溶液,1mL盐酸羟胺,摇匀。再加入2mL Phen,5mL NaAc溶液,以水稀释至刻度,摇匀。立刻用1cm比色皿,以蒸馏水为参比溶液,在选定的波长下测量吸光度。然后依次测量放置5min,10min,30min,60min,120min,……后的吸光度。以时间t为横坐标,吸光度A为纵坐标,绘制A与t关系的显色时间影响曲线。得出铁与邻二氮菲显色反应完全所需要的适宜时间。
2. 铁含量的测定
(1)标准曲线的制作 用移液管吸取10mL 100μg·mL-1铁标准溶液于100mL容量瓶中,加入2mL 6mol·mL-1HCl溶液,用水稀释至刻度,摇匀。此溶液Fe3+的浓度为10μg·mL-1。
在6个50mL容量瓶(或比色管)中,用吸量管分别加入0.00mL,2.00mL,4.00mL,6.00mL,8.00mL,10.00mL 10μg·mL-1铁标准溶液,均加入1mL盐酸羟胺,摇匀。再加入2mL Phen,5mLNaAc溶液,摇匀。用水稀释至刻度,摇匀后放置10min。用1cm比色皿,以试剂空白(即0.00mL铁标准溶液)为参比溶液,在所选择的波长下,测量各溶液的吸光度。以含铁量为横坐标,吸光度A为纵坐标,绘制标准曲线。
由绘制的标准曲线,重新查出某一适中铁浓度相应的吸光度,计算Fe2+-Phen络合物的摩尔吸光系数ε。
(2)试样中铁含量的测定 准确吸取适量试液于50mL容量瓶(或比色管)中,按标准曲线的制作步骤,加入各种试剂,测量吸光度。从标准曲线上查出和计算试液中铁的含量(单位为μg·mL-1)。
六、思考题
1. 本实验量取各种试剂时应采用何种量器较为合适?为什么?
2. 试对所做条件试验进行讨论并选择适宜的测量条件。
3. 怎样用吸光光度法测定水样中的全铁(总铁)和亚铁的含量?试拟出一简单步骤。
4. 制作标准曲线和进行其它条件试验时,加入试剂的顺序能否任意改变?为什么?
实验十 熟料水泥全分析
一 实验目的
1、掌握配位滴定法的基本原理;
2、学会并正确运用配位滴定法对熟料水泥进行全分析;
3、正确纪录实验数据,掌握实验数据处理的一般方法和技巧。
二 实验学时:10学时
三 实验提示
熟料水泥的主要化学成分为SiO2,Fe2O3,Al2O3,MgO和CaO。其中SiO2可用容量法或重量法测定,若采用重量法测定,试样用酸分解后,即可析出无定形硅酸沉淀,但沉淀不完全,而且吸附严重。本实验是将试样与7~8倍固体NH4Cl混匀后,再加HCl分解试样。此时,由于是在含有大量电解质的小体积溶液中析出硅酸,有利于硅酸的凝聚,沉淀也较完全。硅酸的含水量少,结构紧密,吸附现象也有所减少。试样分解完全后,加适量的水溶解可溶性盐类,过滤,将沉淀灼烧称量,即可测得SiO2的含量。
水泥熟料中的铁、铝、钙、镁等组分以离子形式存在于滤去SiO2沉淀的滤液中,它们都与EDTA形成稳定的络离子,但这些络离子的稳定性有较明显的差别。因此控制适当的酸度就可用EDTA分别滴定它们。调节溶液的pH值为1.8~2.2,以磺基水杨酸作指示剂,用EDTA滴定Fe3+离子,然后加入一定量过量的EDTA,煮沸,待Al3+离子与EDTA完全络合后,再调节溶液的pH≈4.2,以PAN作指示剂,用CuSO4标准溶液滴定过量的EDTA,从而分别测得Fe2O3和Al2O3的含量。滤液中的Ca2+离子和Mg2+离子,按常法用三乙醇胺掩蔽Fe3+和Al3+离子后在pH≈10时用EDTA滴定,测得钙和镁的总量;另取一份滤液在pH>12时,用EDTA滴定钙的含量,然后计算试样中CaO和MgO的含量。
四 实验试剂与仪器
1、试剂
(1)钙指示剂:钙指示剂与NaCl以1∶100混合磨匀。
(2)磺基水杨酸(10%):10g指示剂溶于100mL水中。
(3)PAN指示剂(0.3%):0.3g指示剂溶于100mL乙醇中。
(4)KB指示剂:1g酸性铬蓝K,2g萘酚绿B与25gNaCl研细混匀。
(5)铬黑T指示剂:络黑T指示剂与NaCl以1∶100混合磨匀。
(6)金属锌基准物:取无砷的锌,先以6 mol·L-1HCl洗涤,再用蒸馏水冲洗,最后用丙酮洗一次,于100℃烘干。
(7)氨缓冲溶液(pH≈10):27gNH4Cl溶于适量水中,加浓氨水197mL,稀释至500mL。
(8)HAcNaAc缓冲溶液(pH≈42):32g无水NaAc溶于水中,加入50mL冰醋酸,用水稀释至1L。
(9)三乙醇胺(25%):75%三乙醇胺350mL用水稀释至1L。
(10)酒石酸钾钠(5%):50g酒石酸钾钠溶于水,稀释至1L。
(11)浓盐酸(密度1.19kg/L)
(12)HCl溶液(6mol·L-1):浓HCl与水等体积混合均匀。
(13)浓HNO3(密度1.42)
(14)氨水(1∶1):浓氨水与水等体积混合均匀。
(15)AgNO3溶液(0.1 mol·L-1):1.7gAgNO3溶于100mL水中。
(16)NH4Cl(固体)
(17)NaOH溶液(6 mol·L-1):240gNaOH溶于1L水中。
(18)硫酸(1∶1):浓硫酸与水等体积混合均匀。
(19)EDTA(0.01 mol·L-1)标准溶液:称取4gEDTA二钠盐溶于温水中,用水稀释至1L。于pH≈10的氨缓冲溶液中,以铬黑T为指示剂,用锌作基准物,标定EDTA溶液的准确浓度。
(20)CuSO4标准溶液(0.01 mol·L-1):1.3gCuSO4·5H2O溶于水中,加4~5滴1∶1硫酸,用水稀释至0.5L。然后,用下述方法测定CuSO4标准溶液对0.01mol·L-1EDTA标准溶液的体积比。
2、仪器
电子天平、常规定量分析仪器等
五 实验要求与预期目标
1、查阅有关文献,设计并确定一种可行的分析实验方案;
2、完成实验内容,正确纪录实验数据,并对实验数据进行正确的处理与分析;
3、提交完整的研究报告1份(3000-4000字)。
六 思考题
1、熟料水泥全分析的基本原理是什么?
2、熟料水泥全分析具有什么意义?
3、本实验中,哪些物质是掩蔽剂?
七 参考文献
1、武汉大学分析教研室编.分析化学实验.北京:高等教育出版社,2001第四版;
2、蔡炳新陈贻文.基础化学实验.北京:科学出版社,2001第一版;
3、其他(例如下面).
实验十一 三氯化六氨合钴的制备和组成测定
实验目的
(1)掌握三氯化六氨合钴(Ⅲ)的制备方法。
(2)加深对多氧化态金属离子电对、电极电势变化的理解。
(3)了解沉淀滴定法和碘量法。
实验原理
在水溶液中,电对Co(Ⅲ)/Co(Ⅱ)的相应电极电势分别为φAθ=1.84V及φBθ=0.17V,因而在通常情况下,水溶液中Co(Ⅱ)是稳定的。按照配位理论,六配位八面体场中,d6构型的Co3+在强场中的稳定化能要比d7构型的Co2+大,因而它们的六配位配合物往往是3价稳定性高于2价稳定性。或者说,生成六配位的低自旋配合物后,增加了Co2+的还原性。以钴的六氨配合物为例, =0.1V,说明在水合状态下不稳定的Co3+离子变为氨配合物后稳定性大为提高。事实上,空气中的氧即可将[Co(NH3)6]2+氧化为[Co(NH3)6]3+:
=0.1V,说明在水合状态下不稳定的Co3+离子变为氨配合物后稳定性大为提高。事实上,空气中的氧即可将[Co(NH3)6]2+氧化为[Co(NH3)6]3+:
2[Co(NH3)6]2++1/2O2+H2O=2[Co(NH3)6]3++2OH-
但在实际制备中,很少用鼓空气于体系中的方法来进行氧化过程,这主要是因为氨的挥发性的缘故。常使用不致引入杂质的H2O2作氧化剂。
本实验利用活性炭的选择催化作用,在有过量氨和氯化铵存在下,以过氧化氢为氧化剂氧化Co(Ⅱ)溶液,制备标题化合物:
2[Co(H2O)]Cl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+4H2O
为了除去产物中混有的催化剂,可将产物溶解在酸性溶液中,过滤除去活性炭,然后在高浓度盐酸存在下使产物结晶析出。
三氯化六氨合钴(Ⅲ)为橙黄色单斜晶体,293K下在水中饱和溶解度为0.26 mol·L-1。在水溶液中,K不稳=2.2×10-34;在室温下基本不为强碱或强酸所破坏,只有在煮沸的条件下,才为过量强碱以下式所分解。
2[Co(NH3)6]Cl3+6NaOH=2Co(OH)3+12NH3+6NaCl
本实验利用上述反应对配合物的组成进行测定:①用过量标准酸吸收反应中逸出的氨,再用标准碱反滴剩余的酸,从而测定出氨的含量;②过滤出Co(OH)3后,滤液中的Cl-与Ag+标准溶液作用,定量生成AgCl沉淀,由Ag+标准溶液的消耗量可以确定样品中Cl-的含量;③滤出的钴(Ⅲ)氢氧化物,在酸性介质中与KI作用,定量析出I2,用标准Na2S2O3溶液滴定,由下式计算Co的含量。
Co(OH)3+3H++I-=Co2++1/2I2+3H2O
I2+2S2O32-=2I-+S4O62-
实验试剂与器材
1.试剂:
台秤 分析天平(0.1mg) 烘箱 恒温水浴 抽滤装置一套 漏斗和漏斗架
温度计 酸式滴定管 碱式滴定管
2.药品
酸:HCl标准溶液(0.5 mol·L-1) HCl(6 mol·L-1,浓) HNO3(6 mol·L-1)
碱:NaOH标准溶液(0.5 mol·L-1) NaOH(10%) NH3.H2O(浓)
盐:Na2S2O3标准溶液(0.1 mol·L-1) AgNO3标准溶液(0.1 mol·L-1) K2CrO4(5%)
固体:CoCl2.6H2O NH4Cl KI 活性炭
3.其它:
H2O2(6%) C2H5OH(无水)淀粉溶液(1%)冰块
定量滤纸(中速) pH试纸
实验步骤1.三氯化六氨合钴(Ⅲ)的制备
在100mL锥形瓶中加入6g CoCl2.6H2O(s)水,4g NH4Cl和7mL水温热溶解后加入0.1~0.2g活性炭。冷却,往体系加入14mL浓NH3.H2O,在低于283K的温度下,缓缓加入14mLH2O2(6%)之后,将反应容器置于60℃左右的水浴上,恒温,搅拌20分钟。用冷水冷却,抽滤。将沉淀转移到含有2mL浓盐酸的50mL沸水中,溶解完全后,趁热过滤。弃去固体(活性炭),往滤液中慢慢加入7mL浓盐酸,冷水冷却。抽滤,用少量乙醇洗涤晶体。于105℃下烘干后称量,计算产率。
2.产物组成的测定
(1)氨含量测定在分析天平上准确称取0.2~0.3g三氯化六氨合钴(Ⅲ)样品,置于250mL锥形瓶中,加入80~100mL的水溶解。在另一锥形瓶中用移液管准确加入40.00mL标准HCl溶液(0.5mol.L-1),将三角瓶置于冰水浴中,系统装置如图23—1所示。安全漏斗下端固定于一盛有4mL左右NaOH (10%)溶液的小试管内,使漏斗柄浸入试管液面下2~3mm,整个过程中漏斗柄的出口不能暴露在液面上。试管口的塞子要多钻出一个连通孔,以便试管内与锥形瓶连通。往样品溶液中加入10mL NaOH(10%)溶液,塞紧锥形瓶口。以盛有标准HCl溶液的锥形瓶为接受器,将氨导管插入该接受器其液面下20~30mm。确认装置密封性合乎要求后,加热样品溶液,初用大火,至沸后改为小火,保持微沸状态约1小时。蒸出全部氨以后,拔掉氨导管,停止加热,用少量水将导管内外可能黏附的溶液洗入锥形瓶内,以甲基红为指示剂,用0.5 mol·L-1NaOH标准溶液滴定剩余盐酸,从而求出样品中氨的含量。
(2)氯含量测定将本实验2(1)总蒸出氨的样品溶液中以中速定量滤纸过滤,并用水洗涤滤纸条及沉淀数次,沉淀供本实验2(3)钴含量测定之用。滤液承接于250mL锥形瓶中并以HNO3(6 mol·L-1)酸化至pH5~6, K2CrO4(5%)为指示剂,用标准AgNO3(0.1 mol·L-1)溶液滴定其中Cl-含量,从而计算出样品中的氯含量。
(3)钴含量的测定将本实验2(2)中得到的三价氢氧化物沉淀连同滤纸一并转移到250mL碘量瓶中,加50mL水,用玻璃棒将滤纸尽可能的搅碎,加入1g固体KI,摇荡使其溶解,再加入12mL HCl(6 mol·L-1)酸化,置暗处约10分钟。反应如下:
2Co(OH)3+6H++2I-=2Co2++I2+6H2O
用0.1 mol·L-1标准Na2S2O3滴定析出的的I2,至滴定溶液为浅黄色时,加2mL淀粉(1%)指示剂继续滴定至蓝色刚好消失为止。依据消耗的标准硫代硫酸钠的体积和浓度,即可计算出样品中钴的含量。为清除滤纸影响,可同时作空白实验。
根据上述分析结果,求出产品的实验式。
*废液和固体废弃物倒入指定容器中。
数据处理
实验思考
(1)在制备过程中水浴加热20分钟的目的是什么?能否加热至沸?
(2)制备过程需要用7mL浓盐酸,为什么?
(3)在用NaOH滴定过量HCl时,为何不用酚酞作指示剂,而用甲基红?
(4)测定Cl-余量时,HNO3酸化试液酸度为何不能过大?
(5)要使本实验制备的产品产率高,那些步骤是比较关键的?为什么?
实验十二 硫酸四铵合铜(Ⅱ)的制备,组成分析及物性测定(综合实验)
实验目的
通过硫酸四铵合铜的制备,分析到确定组成的全过程,掌握某些物性测试和结构测试的方法。
实验原理
配合物中铜离子的含量可通过比色分析测定。在配合物溶液中加入强碱,并加热使配合物破坏,氨就能会发出来,用标准酸吸收,再用标准碱滴定剩余的酸,即可测得氨含量。硫酸根含量的确定用重量法。这样,就能确定配合物的化学式。
通过X射线粉末衍射法。这样,就能确定配合物的晶体结构。
配合物中心离子铜的d电子组态及配合物的磁性可由磁化率测定确定。
在过渡金属配合物中,由于受配体的影响,中心离子的d轨道会分裂成能量不同的两组或两组以上的轨道,其能量最高和最低的d轨道之间的能量差称为分裂能,用△表示。可通过测定配合物的电子光谱,由一定的吸收峰所对应的波长来计算.。当d电子数目不同,配合物的构型不同时,计算△值的方法也不同。d1,d4,d6,d9电子,构型为八面体和四面体,其电子光谱只有一个简单的吸收峰,可直接由吸收峰位置的波长来计算△值。
实验步骤
一、 硫酸四铵合铜的制备
取10gCuSO4.5H2O溶于14mL水中,加入20mL浓氨水,沿烧杯壁慢慢滴加35mL95%的乙醇,然后盖上表面皿。静置析出晶体后,减压过滤,晶体用1:2的乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在60℃左右烘干,称重,保存待用。
二、硫酸四铵合铜的组成测定
1. NH3的测定

图错误!未定义书签。 测定氨的装置
称取0.25-0.30g(称准至0.0002g)样品,放入250mL锥形瓶中,加80mL水溶解,再加入10 mL10%的NaOH溶液。在另一锥形瓶中,准确加入30-35mL标准HCl溶液(0.5mol•L-1),放入冰浴中冷却。
按图1装配好仪器,从漏斗中加入3-5 mL10% NaOH溶液于小试管中,漏斗下端插入液面下2-3cm。加热样品,先用大火加热,当溶液接近沸腾时改用小火,保持微沸状态,蒸馏1h左右。即可将氨全部蒸出。蒸馏完毕后,取出插入HCl溶液中的导管,用蒸馏水冲洗导管内外,洗涤液收集在氨吸收瓶中,从冰浴中取出吸收瓶,加2滴0.1%的甲基红溶液,用标准NaOH溶液(0.5mol•L-1)滴定剩余的溶液。此过程中反应式如下:
Cu(NH3)4SO4+NaOH=CuO↓+4NH3↑+Na2SO4+H2O
按下式计算NH3含量
NH3%=
式中:c1v1:标准HCl溶液的浓度和体积; C2V2:标准NaOH 溶液的浓度和体积
G:样品质量: 17.04:NH3的摩尔质量
2. SO42-的测定
用重量法分析SO42-含量。
3. Cu2+的测定
(1)绘制工作曲线
取标准CuSO4溶液(0.2mol•L-1)配制100mL浓度分别为0.0100,0.00800,0.00500,0.00200mol•L-1的CuSO4溶液。
取上面配制的四种浓度的CuSO4溶液各10.00 mL,分别加入10.00 mL氨水溶液(2 mol•L-1),混合后用2 cm比色皿在波长λ为610 nm的条件下,用72型分光光度计测定溶液吸收度,以吸收度A~Cu2+浓度作图。
(2)Cu2+的含量测定
称取0.34~0.37g(标准至0.0002g)样品,用5mL水溶解后,滴加H2SO4(6mol·L-1)至溶液从深蓝色变至蓝色(表示配合物已解离),定量转移到250mL容量瓶中,稀释至刻度,摇匀。取出10.00mL,加入10.00mL氨水(1mol•L-1),混合均匀后,在与测定工作曲线相同的条件下测定吸光度。
根据测定得的吸光度,从工作曲线上找出相应的Cu2+浓度,并按下式计算Cu2+含量:
Cu2+%=
式中: c:工作曲线上查出的Cu2+浓度; G:样品质量;
63.54:Cu摩尔质量。
三、硫酸四氨合铜的物性测定
1. X射线粉末衍射法确定[Cu(NH3)4]SO4·H2O的晶体结构
用X射线衍射仪在以下条件时测定样品。
管流:15mA(Cu靶);抛描速度:4°·min-1;扫描范围:2θ从90°~10°;量程(CPS):10k;时间常数:0.1×20;记录走速:20mm·min-1。
2.磁化率的测定
用古埃磁天平在3/4∏×106A·m-1(在数值上等于3000G)的条件下测定样品的磁化率。
3.吸收曲线的测定
将样品配成浓度为0.01mol·L-1的溶液,以蒸馏水作参考,在721型分光光度计的整个波长范围内,每隔10nm测一次吸光度。
结果及讨论
一. 实验结果
1. 根据组成分析的实验结果,确定所测样品中Cu2+,NH3,SO42-和H2O的百分含量,并定出样品的实验式。
2. 根据X衍射图确定该配合物的晶形。
3. 根据测得的磁化率计算磁矩,并确定Cu2+的外层电子结构。
4. 根据测得的吸光度,作吸光度~波长曲线。在图上找出最大吸收处的波长,可用下式计算[Cu(NH3)4]2+的分裂能。
△ =1/λ×107(cm-1)
式中:λ为最大吸收的波长(nm)。
5. 理论值和文献值
(1)组分含量
理论值:Cu2+% 25.85,NH3% 27.73,SO42-% 39.08,H2O% 7.33。
(2)晶形
文献值:正交晶系。
(3)磁矩值
文献值:1.72~2.20(μB)
(4)分裂能
文献值:15100(cm-1)
二. 讨论
1.各组分的含量测定还可用其它方法:
(1)用硫酸滴定铜氨配合物测得NH3含量。反应式为:
Cu(NH3)42++(n-2)H++ 2 H2O =Cu(OH)2+ nNH4+
Cu(OH)2+ 2 H+= Cu2++2 H2O
在实验中,通过pH滴定测得滴定曲线,可得到以上二步反应完全时所用的酸的体积,从而计算NH3的个数或NH3的含量。
(2)将铜氨配合物溶于过量的盐酸中,再用氢氧化钠滴定此溶液。通过pH滴定也能测得NH3的含量。
(3)用氨气敏电极,直接电位法测定NH3含量。
(4)用配合滴定,以铬黑T作指示剂,用EDTA滴定,测得Cu2+含量。
(5)用磺量法测Cu2+含量,在酸性溶液中(pH=3~4),Cu(NH3)42+被破坏,Cu2+与I—作用,产生I2,再用Na2S2O3溶液滴定I2,即可得Cu2+含量。
2.一般说来,根据磁性能判断配合物中心原子的氧化态及电子构型和立体结构有一定困难。因Cu2+有三种可能的成键构型,二种不同的立体结构。这三种成键构型是:
(1) 离子性四面体
(2) 共价性四面正方形dsp2
(3) 共价性四面体sp3
其中每种都含有一个未成对的电子因而无法区别,需用其它方法来确定。
3.讨论配位数。在一些书中铜配合物表示成[Cu(H2O)6]2+,[Cu(NH3)6]2+等,它的配位数是6,但在另一些书上则写成[Cu(NH3)4]2+,配合物是4。为什么会有二种不同的写法呢?较为确切的解释是:当Cu2+溶解在过量的水中时,形成蓝色的水合离子[Cu(H2O)6]2+。在[Cu(H2O)6]2+中加入氨水时,形成深蓝色的[Cu(NH3)4(H2O)2]2+,第5,6二个水分子的取代较困难,只有在液氨中才能制得[Cu(H2O)6]2+。在固体水合盐中一般配位数为4。
4.讨论立体结构。Cu2+的配位离子是变形八面体或平面四方形结构,在[Cu(NH3)4(H2O)2]2+中,四个NH3以短键和Cu2+结合,经常用[Cu(NH3)4(H2O)2]2+来表示,所以这个配离子也可以用四方形结构描述。用价键理论无法说明Cu2+的配合物为平面四边形结构,因为形成dsp2构形必需激发一个电子从3d进入4p轨道,即统计,在其态时这样的激发需能量1422.56KJ,且电子位于高能的4p轨道容易失去,这恰与实验事实相反,因为Cu2+的配合物非常稳定,难于氧化成Cu3+的配合物。
思考题
1、 重量法测定SO42-含量时,为了得到较大结晶颗粒的BaSO4,沉淀条件是什么?
2、 在转移,洗涤,灼烧BaSO4时,应注意些什么?
3、 不同励磁电流下测得的样品摩尔磁化率是否相同?
参考文献
[1] 罗勤慧,沈孟长编著,配位化学,江苏科技出版社,1978年
[2] 北京师范大学等校编,无机化学,高等教育出版社,1988年
[3] 方惠群,虞振新等编,电化学分析,原子能出版社,1984年
[4] 吉林大学等校编,物理化学基本原理,人民教育出版社,1977年
实验十三 由碳酸氢铵和食盐制备碳酸钠(综合实验)
实验目的
1、 通过实验了解联合制碱法的反应原理,学会利用各种盐类溶解度的差异,并通过复分解反应制取盐的方法。
2、 初步掌握测定碳酸钠中碳酸氢钠含量的定量分析方法。
预习要点
一、预习氨碱法和联合制碱法制备纯碱的原理以及酸碱中和原理。
二、思考并回答下列问题
1、为什么要预先去食盐中含钙、镁离子?而不预先除去硫酸根离子?
2、为什么计算Na2CO3产率时要根据NaCl的用量?影响Na2CO3产率的因素有哪些?
3、 、
、 、
、 和
和 四种盐不同温度下在水中的溶解度(g/100gH2O)如表所示。
四种盐不同温度下在水中的溶解度(g/100gH2O)如表所示。
表  、
、 、
、 和
和 溶解度对照表
溶解度对照表
温度
(℃)
溶解度
盐
| 0
| 10
| 20
| 30
| 40
| 50
| 60
| 70
| 80
| 90
| 100
|
NaCl
NH4HCO3
NaHCO3
NH4Cl
| 35.7
11.9
6.9
29.4
| 35.8
15.8
8.15
33.3
| 36.0
21.0
9.6
37.2
| 36.3
27.0
11.1
41.4
| 36.6
-
12.7
45.8
| 37.0
-
14.45
50.4
| 37.3
-
16.4
55.2
| 37.8
-
-
60.2
| 38.4
-
-
65.6
| 39.0
-
-
71.3
| 39.8
-
-
77.3
|
根据表。所列四种盐的溶解度,解释为什么转化操作时溶液的温度最好控制在30—35℃之间。
基本原理
碳酸钠在工业上叫纯碱,是重要的化工原料。目前工业上制纯碱主要采用氨碱法和我国化学家侯德榜(1890—1974)提出的联合制碱法。联合制碱法是将CO2和NH3通入NaCl溶液中先制成NaHCO3,再在高温下灼烧生成Na2CO3,副产物是NH4Cl。主要化学反应可表示如下:


以上第一个反应,可以看成是碳酸氢铵和氯化钠在水溶液中的复分解反应。

 、
、 、
、 和
和 同时存在于水溶液中,是一个复杂的四元交互体系,它们在水溶液中的溶解度互相发生影响。但是,可以根据各种纯净盐在不同温度下在水中溶解度的不同,选择分离几种盐的最佳条件和适宜的操作步骤。
同时存在于水溶液中,是一个复杂的四元交互体系,它们在水溶液中的溶解度互相发生影响。但是,可以根据各种纯净盐在不同温度下在水中溶解度的不同,选择分离几种盐的最佳条件和适宜的操作步骤。
仪器和药品
布氏漏斗、吸滤瓶、马福炉、蒸发皿、分析天平、称量瓶、酸式滴定管(50ml)、量筒(100mL)、烧杯(150mL)、粗食盐、NaOH(3mol·L-1)Na2CO3(3mol·L-1)、HCl(6 mol·L-1)、标准HCl溶液(0.1 mol·L-1)、NH4HCO3(固)、酚酞溶液、甲基橙溶液、温度计(0—100℃)、锥形瓶(250mL)
实验内容
一、碳酸钠的制取
1、化盐和精制 在150mL烧杯中注入50mL 24—25%的粗盐水溶液。用3mol·L-1NaOH和3mol·L-1Na2CO3溶液的混合溶液(体积为1:1)调整PH值至11左右,得到胶状 沉淀,以除去食盐中所含的钙、镁杂质。
沉淀,以除去食盐中所含的钙、镁杂质。


注入混合碱液后,加热至沸,抽滤,分离沉淀。将滤液用6 mol·L-1HCl调整pH值至7。解释为什么要用HCl调整PH值?
2、转化 将盛有滤液的烧杯放在水浴上加热,控制溶液温度在30—35度之间。在不断搅拌的情况下,分多次把21g研细的 加入滤液中,加完后继续保温搅拌半小时,然后静置,抽滤,得到
加入滤液中,加完后继续保温搅拌半小时,然后静置,抽滤,得到 晶体,用少量水洗涤2次,以除去附着在表面的铵盐。再将晶体进行抽滤干燥,称此产物质量。所得母液回收,留作制取氯化铵之用。
晶体,用少量水洗涤2次,以除去附着在表面的铵盐。再将晶体进行抽滤干燥,称此产物质量。所得母液回收,留作制取氯化铵之用。
3、制纯碱 将抽干的 放入蒸发皿中,在马福炉中,于300℃下灼烧2小时,即发生分解反应得到纯碱。等冷却到室温时,称量制得的纯碱的质量。
放入蒸发皿中,在马福炉中,于300℃下灼烧2小时,即发生分解反应得到纯碱。等冷却到室温时,称量制得的纯碱的质量。
二、产品检验
用分析天平准确称取(准确0.001g)制得碳酸钠晶体二份,每份为m克(约0.25g左右)。将其中一份放入锥形瓶中用100ml蒸馏水溶解,滴入2滴酚酞指示剂,使溶液变红色。用已知准确浓度为CHCl的盐酸溶液滴定至溶液的红色刚刚退去,记下所用盐酸体积V1,再滴入2滴甲基橙指示剂,此时溶液应显黄色。继续用上述盐酸溶液滴定,使溶液由黄色至橙色,加热煮沸1—2分钟,冷却后溶液又呈黄色,再用盐酸滴定至橙色,半分钟不退为止。记下所用盐酸总体积V2。样品中Na2CO3和 的百分含量可分别按下式计算:
的百分含量可分别按下式计算:


式中: CHCl——标准HCl溶液的浓度;
V1——第一个滴定终点用去标准HCl溶液的体积;
V2——第二个滴定终点用去标准HCl溶液的体积;
 ——Na2CO3的摩尔质量;
——Na2CO3的摩尔质量;
m——样品质量;
 ——
—— 的摩尔质量;
的摩尔质量;
纯碱的产率计算
理论产量:由粗盐(按90%)计算。
实际产量:由产品质量 Na2CO3的百分含量。
Na2CO3的百分含量。

另一份样品按上述实验步骤和计算方法重复一遍,将数据和结果汇总于表错误!未定义书签。中。
表。 纯碱的分析数据和Na2CO3产率
实验次数
| 样品重量
m/g
| HCl体积/dm3
| HCl浓度
(mol·L-1)
| Na2CO3
%含量
| NaHCO3
%含量
| Na2CO3
产率
|
V1
| V2
|
1
2
|
|
|
|
|
|
|
|
附 录
附录1 相对原子质量表
(国际纯粹与应用化学联合会1993年公布)

附录2 常用化合物的相对分子质量表


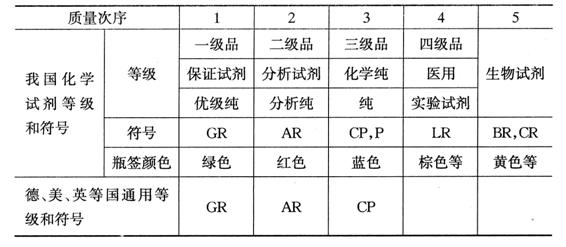
附录3 化学试剂等级对照表

附录4 常用酸碱试剂的密度、含量和近似浓度
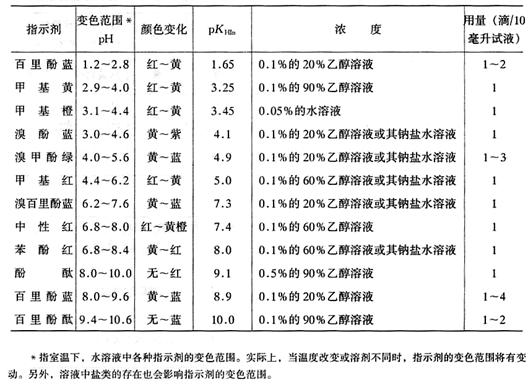
附录5 常用指示剂
1.酸碱指示剂
2.氧化还原指示剂
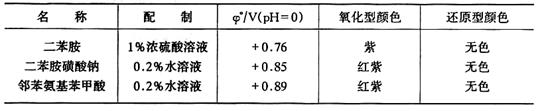
3.络合指示剂
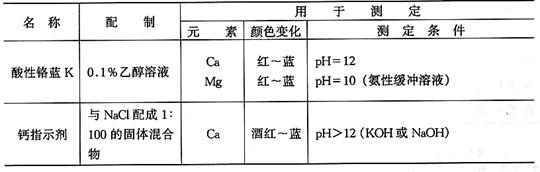

参考文献
1. 武汉大学.分析化学实验,高等教育出版社(第四版),2001年5月.
2. 陈华序,郑沛霖等.分析化学简明教程,冶金工业出版社,1989年6月.
3. 李发美等.分析化学实验指导,人民工业出版社,2004年2月.
4. 四川大学,浙江大学.分析化学实验,高等教育出版社(第三版),2003年6月.
5. 邓玲灵.现代分析化学实验,中南大学出版社,2002年8月.